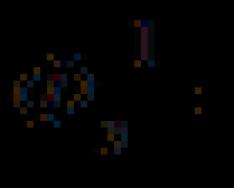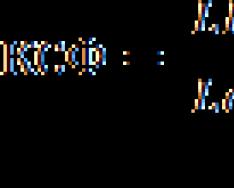Представления о направленности связи и теория гибридизации электронных орбиталей позволяют объяснить геометрическую форму молекул веществ с ковалентными связями, но не могут предсказать ее. Теоретический расчет геометрической конфигурации частицы квантово-механическими методами представляет собой очень сложную и не всегда имеющую однозначное решение задачу. Однако существует довольно простой прием, позволяющий с достаточно высокой надежностью качественно оценить геометрию молекул. Этот прием был разработан Р. Гиллеспи и получил название: метод отталкивания электронных пар валентной оболочки. Метод связывает форму частицы с силами отталкивания, действующими между электронными парами, сформированными при образовании соответствующей молекулы. Метод Гиллеспи особо результативен для молекул, образованных s- и р-элементами.
Концепция отталкивания электронных пар валентной оболочки может быть сведена к следующим основным положениям:
1. Геометрическая форма молекулы определяется числом электронных пар валентной оболочки (ЭПВО), в которые не включают электронные пары, образующие p-связи.
2. Электронные пары валентной оболочки ориентируются так, чтобы отталкивание между ними было минимально.
3. Неподеленные электронные пары занимают больший объем околоядерного пространства, чем связывающие. Следствием неэквивалентности неподеленных и связывающих электронных пар является искажение валентных углов.
Чтобы определить число ЭПВО необходимо сложить число валентных электронов данного атома с числом электронов, предоставленных присоединенными атомами, а затем из полученной суммы вычесть число электронов, образующих p-связи, и разделить полученный результат на два. Так, для молекулы СО 2 , имеющей две s- и две p-связи, каждый атом кислорода предоставляет по два электрона на образование связей с атомом углерода, а атом углерода предоставляет по два электрона на образование связей с каждым атомом кислорода. Соответственно число ЭПВО для атома углерода равно 2:
Число связывающих ЭПВО равно числу s-связей, образуемых центральным атомом (N s); разность равна числу неподеленных электронных пар: N нп = N ЭПВО - N s .
Идеальные геометрические формы, отвечающие различным значениям числа ЭПВО и неподеленных электронных пар, приведены в табл. 6, в скобках указан атом, для которого определяется тип гибридизации.
Если валентная оболочка атома в молекуле включает две электронные пары, два одноименных точечных заряда, оказавшись на поверхности сферы, расположатся на концах диаметра большого круга. Соответственно две ЭПВО должны занять орбитали, обеспечивающие валентный угол 180°, что согласно методу валентных связей отвечает sp-гибридизации атомных орбиталей. Максимальному удалению и минимальному отталкиванию трех ЭПВО будет отвечать ориентация орбиталей от центра к вершинам равностороннего треугольника (sp 2 -гибридизация). Четырем ЭПВО соответствует тетраэдрическая конфигурация (sp 3 -гибридизация). В случае пяти ЭПВО наиболее выгодным является распределение электронных пар по направлениям к вершинам тригональной бипирамиды (sp 3 d-гибридизация), шести ЭПВО соответствует октаэдрическая конфигурация (sp 3 d 2 -гибридизация).
При наличии неподеленных электронных пар геометрия молекулы изменяется в зависимости от их числа. Как видно из табл. 6, в случае трех ЭПВО молекулы могут быть угловыми (N нп = 1) и линейными (N нп =2). Наличие в валентной оболочке четырех электронных пар допускает образование тригонально-пирамидальных при N нп = 1, угловых при N нп = 2 и линейных (N нп = 3) молекул.
Если число ЭПВО равно пяти и все пары являются связывающими, молекула имеет форму тригональной бипирамиды. При наличии неподеленных электронных пар необходимо знать, какие орбитали, аксиальные или экваториальные, будут заняты ими. Расчет показывает, что более выгодным является экваториальное положение. Действительно, занимающие экваториальное положение неподеленные пары имеют только двух ближайших соседей под углом 90 °, тогда как при аксиальном положении таких соседей было бы три, что привело бы к более сильному отталкиванию. В результате молекула с одной неподеленной парой имеет форму бисфеноида (искаженный тетраэдр), с двумя - Т-форму, а трем неподеленным парам соответствуют линейные молекулы.
Таблица 6.
Геометрия молекул s- и p-элементов
| N ЭПВО | Тип гибридизации | Число неподеленных пар | |||
| sp | линейная BeF 2 (Be) | линейная AlF (Al) | |||
| sp 2 | треугольник BF 3 (B) | угловая SnCl 2 (Sn) | линейная NH (N) | ||
| sp 3 | тетраэдр CF 4 (C) | тригональная пирамида NH 3 (N) | угловая Н 2 О (О) | линейная IF (I) | |
| sp 3 d | тригональная бипирамида PF 5 (P) | бисфеноид SF 4 (S) | T-форма IF 3 (I) | Линейная XeF 2 (Xe) | |
| sp 3 d 2 | октаэдр SF 6 (S) | тетрагональная пирамида BrI 5 (Br) | квадрат XeF 4 (Xe) | Т-форма - (Xe) |
В случае шести ЭПВО неподеленные пары занимают в октаэдре транс-положение друг относительно друга. В силу этого для шести ЭПВО реализуются следующие формы молекул: октаэдр (N нп = 0), тетрагональная пирамида (N нп = 1), квадрат (N нп = 2) и т.д..
Чтобы определить геометрическую форму молекулы по методу Гиллеспи, необходимо знать электронные конфигурации атомов, порядок соединения этих атомов в молекуле, число s- и p-связей в образовавшейся частице и учесть эффекты, приводящие к искажению валентных углов.. Рассмотрим несколько примеров.
Пример 1 . Для молекулы COCl 2 , в которой атом кислорода образует с углеродом двойную связь, а атомы хлора – одинарные (рис. 20а), числа ЭПВО и неподеленных пар составляют:
N ЭПВО (C) = ![]() ; N нп (С) = 3 - 3 = 0
; N нп (С) = 3 - 3 = 0
Поэтому молекула COCl 2 должна иметь форму равностороннего треугольника с валентными углами, равными 120°. В действительности же эта молекула имеет форму равнобедренного треугольника (d C = O = 117 пм, d C - Cl = 175 пм, Ð ClCO = 124 °, Ð С lCCl = 111 °). Поскольку кратные связи занимают больший объем у центрального атома, что приводит к сжатию валентных углов.
Пример 2 . Для молекулы CHCl 3 число ЭПВО и связывающих пар одинаково (N ЭПВО = 4, N нп = 0), однако молекула хлороформа не имеет форму правильного тетраэдра (d C - Cl =176 пм, d C - H = 110 пм, ÐClCCl = 111,3 °, ÐHCCl = 107,5°). Это связано с неравноценностью присоединенных атомов: атом водорода и атомы хлора имеют различные радиусы и образуют различные по длине связи с атомом углерода.
Пример 3 . Определим форму молекулы оксофторида ксенона XeO 2 F 2 , в которой центральным является атом ксенона, образующий четыре s- и две p-связи (рис. 20б).
Числа ЭПВО и неподеленных пар валентной оболочки хсенона составляют:
N ЭПВО (Xe) = ![]() ; N нп (Xe) = 5 - 4 = 1
; N нп (Xe) = 5 - 4 = 1
В соответствии с табл. 10 образующаяся молекула имеет форму бисфеноида, в котором атомы кислорода образуют связи за счет экваториальных орбиталей, обеспечивающих этим атомам максимальное удаление от орбитали, занятой неподеленной парой, а атомы фтора, имеющие по три неподеленные пары, находятся в транс-положении. Можно ожидать, что длина двойных связей Xe=O будет меньше длины одинарных связей Xe-F, а углы OXeO и FXeF в связи с наличием неподеленной пары на экваториальной орбитали будут меньше 120 ° и 180 ° соответственно. Эти предположения хорошо согласуются с результатами экспериментального определения формы рассматриваемой частицы: молекула XeO 2 F 2 действительно имеет форму слегка искаженного бисфеноида (d Xe = O = 171 пм, d Xe - F = 190 пм, ÐOXeO = 105,7 °, ÐFXeF = 174,7°).
Пример 4 . Определим геометрию газообразного метабората натрия (рис. 20в).
При определении геометрии сложных молекул, содержащих цепочки из четырех и более атомов, рационально разбить молекулу на фрагменты и определить геометрию каждого из них отдельно. Для метабората натрия следует порознь определить форму фрагментов O=B-O и B-O-Na. Для атома бора:
N ЭПВО (В) = ![]() N нп (В) = 2 - 2 = 0;
N нп (В) = 2 - 2 = 0;
т.е. фрагмент O=B-O имеет линейную форму.
N ЭПВО (О) = ![]() N нп (O) = 4 - 2 = 2
N нп (O) = 4 - 2 = 2
Таким образом, фрагмент B-O-Na имеет угловую форму, валентный угол близок к 109,5 °. Молекула NaBO 2 действительно представляет собой сочетание линейного и углового фрагментов с валентными углами 180 ° и 109 ° (рис. 20в).

Рис. 20. Структурные формулы молекул СOCl 2 (а), XeOF 2 (б), NaBO 2 (в).
Пример 5. Определим геометрию иона IO 2 F 2 - .
Если частица является ионом, то при расчете числа ЭПВО следует вычесть заряд иона из числа валентных электронов. Для атома иода, являющегося центральным и образующего четыре s- и две p-связи:
N ЭПВО (I) = ![]() N нп (I) = 5 - 4 = 1
N нп (I) = 5 - 4 = 1
Рассматриваемый ион должен иметь форму бисфеноида, что подтверждено экспериментально.
Для построения энергетической диаграммы МО многоатомной молекулы необходимо заранее знать ее геометрическое строение. Обычно оно устанавливается экспериментально, но во многих случаях его можно очень просто предсказать. Такую возможность дает метод отталкивания электронных пар валентной оболочки, предложенный в 1957 г. Р. Гиллеспи.
В основе метода Гиллеспи лежит представление о том, что электроны или что более правильно, области повышенной электронной плотности в валентном окружении центрального атома должны располагаться в пространстве так, чтобы их взаимное отталкивание было наименьшим. Как нам известно, такие области соответствуют либо ковалентным связям, образуемым этим атомом, либо его неподеленным электронным парам. Поэтому можно сказать, что для ослабления межэлектронного отталкивания связи и неподеленные пары центрального атома должны располагаться на максимально возможном удалении друг от друга.
Конфигурации, обеспечивающие наименьшее взаимное отталкивание двух, трех, четырех, пяти и шести областей повышенной электронной плотности: 2-линейная, 3-равносторонний тругольник, 4-тетраэдр, 5-тригональная бипирамида, 6-октаэдр.
Например, в молекуле гидрида бора ВН3, наименьшее отталкивание трех областей повышенной электронной плотности, соответствующих связям В-Н, достигается при условии, что эти связи направлены к вершинам правильного треугольника.
В молекуле метана СН4 наименьшее отталкивание четырех областей повышенной электронной плотности (связей С-Н) достигается при их тетраэдрическом расположении вокруг центрального атома углерода. Следовательно, эта молекула должна иметь форму тетраэдра с направленными к его вершинам связями С-Н. Атом азота в молекуле аммиака NH3 окружают четыре области повышенной электронной плотности. Три из них соответствуют связям N-H и одна - неподеленной электронной паре. Как и в предыдущем примере, они должны быть направлены к вершинам тетраэдра. Однако ту вершину, которая занята неподеленной электронной парой, мы "не видим". Поэтому молекула аммиака имеет форму тригональной (т. е. треугольной) пирамиды с атомом азота в ее вершине и тремя атомами водорода - в основании.
Еще один пример - молекула диоксида углерода СО2. В ней имеются две двойные связи С=0 и, соответственно, две области повышенной электронной
плотности, каждая из которых образуется за счет двух электронных пар. Очевидно, что наименьшее их отталкивание достигается при линейном строении молекулы.
Теперь сформулируем порядок определения геометрии молекулы методом Гиллеспи.
Сначала определяют число областей повышенной электронной плотности (п) в окружении центрального атома. Для этого подсчитывают число образуемых им связей, как одинарных, так и кратных, и число имеющихся у него неподеленных электронных.
Затем выбирают соответствующую числу п фигуру или многогранник. В центр этой фигуры или многогранника помещают центральный атом.
Наконец мысленно удаляют у многогранника или фигуры те вершины, которые соответствуют неподеленным электронным парам, и получают наблюдаемую форму молекулы.
Рассмотрим еще несколько примеров.
В молекуле фосгена COCI2 атом углерода образует двойную связь с атомом кислорода и две одинарные - с атомами хлора. Так как неподеленных электронных пар у атома углерода в этой молекуле нет, число п равно трем и молекула имеет форму треугольника.
В нитрит-анионе NO2- атом азота образует связи с двумя атомами кислорода: на одну он расходует два своих валентных электронов, а на другую - один. У атома азота остается также неподеленная электронная пара, которая вместе с двумя связями образует три области повышенной электронной плотности, направленные к вершинам треугольника. В одной из них - неподеленная пара, не учитываемая при описании взаимного расположения атомов. Поэтому анион NO2- имеет угловую форму с валентным углом между связями N-O близким к 120 градусам. Вокруг центрального атома хлора в хлорат-анионе СlO3- располагаются три области электронной плотности, соответствующие трем связям С1-0, и одна неподеленная электронная пара. Поэтому этот ион имеет строение тригональной пирамиды, аналогичное строению аммиака.
Молекула пентахдорида фосфора PCI5 имеет форму тригональной бипирамиды, которую образуют пять связей P-CI.
Наилучшие результаты метод Гиллеспи дает при предсказании строения соединений непереходных элементов. Однако даже для них выполненные с его использованием прогнозы иногда оказываются ошибочными, хотя число таких ошибочных прогнозов и невелико. Например, молекула BaF2 по прогнозу должна иметь линейное строение, тогда как экспериментально определенный валентный угол в этой молекуле равен 100 градусов. Напротив, линейная молекула Li2О прогнозируется методом Гиллесии как угловая.
Геометрия многоатомных молекул определяет их полярность. Молекулы, имеющие форму правильной геометрической фигуры или правильного многогранника, всегда являются неполярными. Это связано с тем, что все смешения электронной плотности на каждой связи в сторону более электроотрицательного элемента компенсируют друг друга. Так, например, молекула PCI5 имеет форму правильного многогранника - тригональной бипирамиды и поэтому неполярна.
Если же молекула имеет форму неправильного многогранника или в правильном искажены некоторые углы, то она оказывается полярной. Например, связи P-Cl в трихлориде фосфора образуют тригональную пирамиду с атомом фосфора в вершине (неправильный многогранник), поэтому молекула PCI3 имеет дипольный момент.
Ван-дер-ваальсовы силы
(Очевиден механизм образования в-в с атомной или ионной связью: образование молекулярных орбиталей, приводящее к понижению потенциальной энергии с-мы в результате перехода электронов на более низко лежащие энергетические уровни, а также перераспределение электронной плотности, обусловливающее электростатическое притяжение между ионами.)
Однако возможно электростатическое притяжение и между нейтральными молекулами, вызванное силами Ван-дер-Ваальса.
1)ориентационное взаимодействие осуществляется между полярными молекулами, которые ориентируются так, чтобы сблизиться разноименными полюсами, результатом чего является притяжение между ними и понижение потенциальной энергии с-мы при их сближении-соединении
2)индукционное взаимодействие.если молекула не имеет постоянного дипольного момента, то он может в ней возникнуть, индуцироваться(наводиться) под воздействием другой, полярной, молекулы.
3)дисперсионное взаимодействие. В любой молекуле из-за того, что она представляет собой с-му с движущимися зарядами (ядрами, электронами), непрерывно возникают, перемещаются и исчезают так называемые мгновенные микродиполи. При сближении молекул их возникновение перестает быть полностью случайным, независимым; появляется некая согласованность в их образовании.
Таким образом, ванн-дер-ваальсовы обусловлены корреляцией(согласованием) движения электронов в соседних молекулах вследствие кулоновского взаимодействия. Они очень быстро ослабевают с увеличением расстояния между молекулами.относительный вклад каждого типа таких сил зависит в основном от 2-х св-в молекул: полярности(величины дипольного момента) и поляризуемости (способности к более или менее легкому изменению относительного ространственного распределения зарядов внутри молекулы.)
46. Зонное строение твердого тела. Образование энергетических зон в кристаллах простых веществ и в со-единениях с ионным типом связи.
До сих пор мы рассматривали образование химической связи в молекулах, образованных из нескольких атомов. Однако немало веществ состоит не из молекул, а непосредственно из атомов или ионов. Химическую связь в кристаллах таких веществ описывают с помощью зонной теории, которая является развитием метода МО и рассматривает кристалл как одну очень большую молекулу.
///Атомные кристаллы
Представим себе, как образуется кристалл из атомов щелочного металла, каждый из которых имеет только одну валентную s-орбиталь и один электрон на этой орбитали. При соединении двух таких атомов образуются две молекулярные орбитали: связывающая, энергия которой меньше энергии исходных АО, и разрыхляющая, с более высокой энергией. Если соединяются три атома, то образуются три МО, если четыре - то четыре МО и т.д. В кристалле, состоящем из 1 моль атомов, должно образоваться 6,022*10 орбиталей.
Видно, что в молекуле, состоящей из небольшого числа атомов, для перехода электрона на свободную орбиталь требуется довольно большая энергия. По мере того как число взаимодействующих атомов увеличивается, различие в энергиях МО становится все меньше, а при очень большом числе атомов можно сказать, что орбитали образуют практически непрерывную энергетическую зону. В соответствии с принципом наименьшей энергии электроны попарно занимают орбитали нижней половины зоны, оставив верхнюю половину свободной. Электроны, находящиеся в заполненной части зоны, при малейшем возбуждении могут переходить свободные орбитали с более высокой энергией. Вещества с частично заполненной электронами энергетической зоной хорошо проводят электрический ток, т.е. обладают высокой электропроводностью, и называются металлами.
Теперь рассмотрим более сложную ситуацию, возникающую в тех случаях, когда атом имеет несколько валентных орбиталей, как, например, атом углерода (2s и 2р) или алюминия (Зs и Зр). В зависимости от свойств соединяющихся атомов, и от типа образуемой ими кристаллической решетки, образующиеся МО кристалла могут слиться в единую энергетическую зону, а могут сформировать несколько отдельных зон.
При образовании кристалла из N атомов алюминия возникает едина зона, состоящая из 4N орбиталей, из которых 3/2N заполнены электронами, а остальные свободны. Поэтому алюминий является металлом с высокой электропроводностью.
Иную зонную структуру имеет кристалл алмаза. При соединении N атомов углерода образуются две зоны, каждая из которых состоит из 2N орбиталей. Так как у атома углерода есть четыре валентных электрона, легко подсчитать, что все уровни зоны, лежащей на энергетической диаграмме в области более низких энергий, полностью заполнены, а все уровни верхней зоны - свободны. Зона, занятая электронами, называется валентной зоной, а свободная - зоной проводимости. Между валентной зоной и зоной проводимости имеется так называемая запрещенная зона, в которой для электронов нет разрешенных энергетических стояний (т.е. МО). Поэтому для того чтобы приобрести подвижность электрон должен получить дополнительную энергию, превышающую «ширину» запрещенной зоны. В кристалле алмаза, например, эта «ширина» довольно велика и составляет примерно 5,5 эВ, поэтому алмаз является диэлектриком (изолятором).
Для того чтобы алмаз приобрел электропроводность, его надо либо облучать жестким ультрафиолетовым излучением, либо нагреть до температуры в несколько тысяч градусов, Кроме того, перенос электронов в зону проводимости может происходить под действием электрического поля очень высокой напряженности. В этом случае происходит явление, называемое пробоем диэлектрика.
Атом германия имеет такую же электронную конфигурацию, как и атом углерода, а кристаллическая структура германия подобна структуре алмаза. Поэтому в кристаллическом германии также образуются две отдельные зоны. Ширина запрещенной зоны у германия (0,66 эВ) намного меньше, чем у алмаза, и уже при комнатной температуре небольшое количество электронов (примерно один из 10 в 21степени) за счет теплового движения "забрасывается" из валентной зоны в зону проводимости. Этого оказывается достаточно для того, чтобы германий обладал заметной электропроводностью: она у него в 10 раз выше, чем у алмаза, хотя и в 10 раз меньше, чем у типичных металлов. Германий и ряд других веществ с не очень широкой (< 3 эВ) запрещенной зоной (Si, GaAs, PbS) называют полупроводниками.
Полупроводником является и серое олово - кристаллическая модификация, устойчивая при температурах ниже 14°С. Структура серого олова также аналогична структуре алмаза. Однако ширина запрещенной зоны в этом веществе столь мала (примерно 0,1 эВ), что уже при комнатной температуре из валентной зоны в зону проводимости переходит довольно большое количество электронов. Поэтому электропроводность серого олова лишь в 15 раз ниже, чем металлического белого олова - модификации, устойчивой при комнатной и более высоких температурах.
На примере серого и белого олова мы столкнулись с таким важным обстоятельством, что понятия "элементы-металлы" и "вещества, обладающие металлическими свойствами" нетождественны. Элементы-металлы могут образовывать простые вещества-полупроводники (серое олово), а элементы-неметаллы - вещества с металлическим типом химической связи. Например, углерод и мышьяк - элементы-неметаллы, однако образуемые ими простые вещества графит и серый мышьяк обладают электропроводностью металлического типа.
////Ионные кристаллы
Теперь рассмотрим строение энергетических зон в кристаллах, образовав-шихся из сильно различающихся по электроотрицательности атомов. Так как орбитальные энергии исходных атомов сильно различаются, то при перекрывании их АО возникают две отдельные зоны. Зона с низкой энергией (валентная) в основном состоит из орбиталей более электроотрицательных атомов, а зона с высокой энергией (зона проводимости) - из орбиталей менее электроотрицательных атомов.
В кристаллическом NaCl валентная зона полностью занята, а зона проводимости - свободна. Ширина запрещенной зоны в хлориде натрия довольно велика и составляет около 7 эВ. Поэтому кристаллический хлорид натрия, как и большинство других ионных веществ, является при комнатной температуре диэлектриком.
Расплавы ионных веществ (например, NaCl) проводят электрический ток. Однако электропроводность в этих случаях обусловлена подвижностью ионов, а не электронов.
///Структуры ковалентных, ионных и металлических кристаллов. Ковалентные, металлические и ионные радиусы атомов
Кристаллические структуры веществ с различным типом химической связи формируются в соответствии с разными принципами.
В атомном ковалентном кристалле число связей, образуемых каждым из атомов, обычно равно числу его валентных орбиталей. Например, в кристалле алмаза каждый атом углерода находится в тетраэдрическом валентном окружении, как и в молекулах насыщенных углеводородов. В кварце кристаллическом SiO2 каждый атом кремния образует четыре связи с атомами кислорода, а каждый атом кислорода - две связи с атомами кремния.
В ионных веществах каждый анион стремится иметь в своем окружении как можно больше катионов, а каждый катион - как можно больше анионов. Поэтому в ионных кристаллах число соседних противоионов всегда значительно превышает валентность или степень окисления соответствующего атома. Например, в кристалле NaCl каждый анион Сl- окружен шестью катионами Na+ , а каждый катион натрия - шестью хлорид-ионами.
Наконец, в металлических кристаллах валентные электроны так слабо связаны с атомами, что структуру металла часто представляют как совокупность катионов, окруженных "газом" из почти свободных электронов. Поэтому в металлах атомы обычно располагаются так, чтобы при минимальном объеме кристалла расстояния между атомами были наибольшими. Иными словами, атому в таком кристалле выгоднее иметь много удаленных соседей, чем немного близких. Например, в кристаллической структуре а-железа (модификации, устойчивой при температурах ниже 769°С) каждый атом имеет восемь ближних соседей на расстоянии 248 пм и еще шесть более удаленных, расстояние до которых равно 287 пм. Такую же кристаллическую структуру имеют при стандартных условиях все щелочные металлы, барий, хром, молибден, ванадий и ряд других металлов.
Естественно, что расстояния между одними и теми же атомами в кристаллах с различным типом связи имеют разные значения. Например, в ковалентном кристалле серого олова длина связи Sn-Sn равна 280 пм, тогда как в металлическом кристалле белого олова кратчайшее межатомное расстояние составляет 302 пм. Поэтому для предсказания расстояний между атомами используют атомные радиусы различных типов - ковалентные, ионные и металлические. Эти радиусы являются расчетными величинами, определяемыми по уже известным межатомным расстояниям.
За ковалентный радиус атома принимают половину длины одинарной связи между одинаковыми атомами. Например, ковалентным радиусом атома водорода считают половину расстояния Н-Н в молекуле Н2 (37 пм), а ковалентным радиусом атома углерода - половину расстояния С-С в кристалле алмаза (77 пм). Вычисленная с использованием этих значений длина связи С-Н равна 114 пм, что неплохо совпадает с экспериментальной величиной (109 пм в молекуле СН4). Кратные связи короче одинарных, поэтому при расчете их длин либо вводят специальные поправки, либо используют особые значения ковалентных радиусов. Металлический радиус тоже определяют как половину кратчайшего межъядерного расстояния в металлическом кристалле. Металлические радиусы атомов всегда больше ковалентных.
Более сложным образом находят ионные радиусы. При присоединении электрона к нейтральному атому межэлектронное отталкивание в его валентной оболочке усиливается, поэтому радиус аниона больше ковалентного радиуса нейтрального атома. Напротив, размер утратившего электроны катиона меньше размера исходного атома. Поэтому считают, что при образовании ионного кристалла крупные анионы укладываются вплотную друг к другу, а остающиеся между ними пустоты заполняют катионы. Соответственно, за радиус аниона принимают половину кратчайшего межанионного расстояния, а за радиус катиона- разность между кратчайшим расстоянием анион-катион и радиусом аниона.
47. Комплексы. Комплексные соединения – соединения, обладающие рядом признаков:
1) В комплексах всегда можно выделить центральный атом и атомы окружения. Из суммы их зарядов складывается заряд комплекса (положительный 2+, отрицательный 3-, или нейтральный ).
2) Комплексные соединения образуются в результате соединения друг с другом обычных ионов и молекул, причем многоатомные ионы или молекулы входят в состав комплексных частиц целиком, с сохранением всех химических связей.
3) У центрального атома больше химических связей, чем предписывает ему его степень окисления или валентность.(в 4- один ион железа2 окружен 6 цианид ионами)
4) Комплексные частицы в кристаллических веществах и растворах существуют как единое целое.
Комплексные соединения в природе: криолит Na3AlF6 содержит в составе ион 3-, гемм, хлорофилл, витамин В-12 тоже комплексы. Комплексами являются многие ферменты. Комплексы применяются как катализаторы, пигменты, используются для выделения металлов из руд, разделения смесей. (к комплексам не относят двойные соли!!)
Основные понятия:
Комплексообразователь – центральный атом или ион в комплексных частицах (обычно ион или атом металла, хотя бывает и неметалл(2-, -, -.))
Лиганды – нейтральные ионы или молекулы, связанные с комплексообразователем расположенные вокруг его (образуют его координационное окружение). Это молекулы или ионы, способные быть донорами электронных пар(атом, дающий ее – донорный атом). Лиганды бывают монодентатными(образуют одну координационную связь) и полидентатными(несколько, так как в них несколько донорных атомов)
Координационное число – количество связей, которые образует комплексообразователь с лигандами (чаще всего 6,4,2).
Образование комплексов в растворах и их устойчивость.
Комплексные соединения можно получать разными способами (например взаимодействием безводной соли Mg(ClO4)2 с аммиаком, при этом получается (ClO4)2). Однако с практической точки зрения наиболее интересно образование комплексов в водных растворах, содержащих ионы металла-комплексообразователя и лиганды. Энтальпии гидратации большинства катионов достаточно велики, поэтому молекулы воды прочно связаны с ионами металлов и их можно считать координированными лигандами. Такие гидратированные ионы называют аквакомплексами. Частицы, которые образуют с ионами металла более прочные связи, чем молекулы воды, способны вытеснять их из координационного окрхжения комплексообразователя. Процесс замещения происходит ступенчато, каждая ступень характеризуется соответствующей константой равновесия. Например:
1)2+ + NH3 = +H2O K=/=590
2) + + NH3= 2++ H2O K=/[ Ni(NH3)(H2O)52+ ]=170
3) + NH3= 2++ H2O K=/[ Ni(NH3)2(H2O)42+ ]=54
4) + NH3= 2++ H2O K=/[ Ni(NH3)3(H2O)32+ ]=16,6
5) + NH3= 2++ H2O K=/[ Ni(NH3)4(H2O)22+ ]=5,4
6) + NH3= 2++ H2O K=/[ Ni(NH3)5(H2O)2+ ]=1,12
Константы Кi называются ступенчатыми константами образования комплекса(обычно чем больше номер константы, тем меньше ее значение).
Константа суммарного процесса)2+ +6 NH3=2++ H2O обозначается буквой?(бета) и называется константой устойчивости комплекса. Она равна произведению всех ступенчатых констант. Но может считаться и по обычной формуле.
Константу устойчивости можно записать не только для комплекса, но и для любой стадии замещения воды иными лигандами.
Иногда в таблицах приводят константы нестойкости, которые являются константами равновесия реакций разрушения комплексов(замещение лигандов молекулами воды) они являются обратными по отношению к константам устойчивости.
Геометрия молекулы определяется отталкиванием электронных пар в валентной оболочке центрального атома.
Наибольшее место в пространстве занимает неподелённая пара.
Кратная связь подобна неподелённой паре, но большего объёма.
Размер связывающей электронной пары среди элементов одной подгруппы уменьшается с ростом электроотрицательности атома.
Классификация электронных пар: ...бывают связывающие и неподелённые
Классификация атомов в молекуле: a)Центр M - атом с максимальной валентностью (в классическом смысле), с максимальным координационным числом. b)Лиганды X, каждый из которых связан с центром (координационное число, выделяемое на один лиганд, положим равным единице. Это лиганд монодентатный. Бывают и полидентатные лиганды, захватывающие у центра сразу несколько координационных мест). Валентность даже монодентатного лиганда может быть и более единицы.
Неполнота (недостаток) теории ЛЭП: Сформулирована лишь для молекул в спин-спаренных состояниях. Неоднозначно её применение к соединениям d-элементов...
Геометрические следствия из теории ЛЭП, основанной на модели отталкивания электронов определяются с помощью простейшего электростатического подхода.
Модель, положенная в основу теории ЛЭП: отталкивающиеся одинаковые электрические заряды (локализованные пары) плавают на поверхности сферы, в центр которой помещён центральный атом. В таком случае для различного числа пар возможны следующие варианты ориентации орбиталей:
Два плавающих заряда расположатся на полюсах сферы, и оба заряда и центр сферы лежат на одной линии,
Три плавающих заряда расположатся в вершинах равностороннего треугольника на экваториальной плоскости сферы, а центр сферы попадает точно в центр треугольника,
Четыре - в вершинах тетраэдра, вписанного в сферу, и центр сферы находится в центре тетраэдра,
Пять плавающих зарядов могут привести к двум почти эквивалентным ситуациям, а именно:
а) они разместятся в вершинах тригональной бипирамиды, а в её центре расположится центральный атом;
б) они разместятся в вершинах квадратной пирамиды, вписанной в сферу, и центр сферы совпадает с центром её тяжести.
Шесть плавающих зарядов разместятся в вершинах октаэдра, вписанного в сферу, и центр всей системы - в центре октаэдра.
Каждая пара занимает отдельное координационное место в пространстве. Пары подразделяются на: 1) -связывающие, 2) -неподелённые.
Все электронные пары кратной связи занимают одно общее координационное место. В этом смысле они подобны одной паре большего объёма.
Существуют и более сложные пространственные конфигурации, однако они важны уже для экзотических, специальных, случаев.
Вот и все основные правила.
Пространственное распределение электронных пар в оболочке центрального атома во всех случаях полностью согласуется с этой простой моделью. Этот вывод детально проверен теоретически.
Число электронных пар в оболочке атома целое, оно ограничено, оно определяется валентным состоянием атома.
Обратимся к примерам, иллюстрирующим прогнозы теории ЛЭП.
Рассмотрим соединения разных групп Периодической Системы.
1)У молекул соединений элементов 2-й группы реализуется самая простая структура, порождаемая валентной конфигурацией центрального атома вида MX 2 .
У самого центра 2 валентных электрона, а 2 лиганда предоставляют для?-связывания (“в совместное владение” с центром) по 1 электрону. Все эти электроны по правилам ЛЭП следует приписать к центру. Это 2 валентные пары X. Их максимальное отталкивание порождает линейную структуру. Таковы в газовой фазе молекулы BeH 2 , BeCl 2 , HgCl 2 , ... . Все три атома расположены вдоль одной оси.
2) У молекул соединений элементов 3-й группы конфигурация центрального атома содержит 3 валентных электрона, и от каждого лиганда на?-связывание поступает ещё 1 валентный электрон. Оболочке центрального атома следует приписать всего 6 валентных электронов - 3 пары. Их отталкивание порождает молекулярную структуру типа плоского треугольника. Общая формула такой системы MX 3 (полная структура). Таковы молекулы BF 3 (газовая фаза), AlCl 3 (газовая фаза).
3) У молекул соединений элементов 4-й группы центральный атом содержит 4 валентных электрона. В спин-спаренном состоянии электронной оболочки молекулы может быть 4 или 2 лиганда. В зависимости от их числа возможны 2 варианта структуры.
3.1. В четырёхвалентном состоянии центра при четырёх лигандах в поле центра всего 8 связывающих электронов Общая формула такой системы MX 4 (полная структура). Четырём парам отвечают тетраэдрические структуры молекул типа СCl 4 , SiFl 4 , GeCl 4 .
3.2. В двухвалентном состоянии центра суммарное число электронов при одновалентных лигандах равно 6, из них 2 пары обслуживают 2 ?-связи с лигандами X, и 1 пара холостая - пара E. Такую структуру можно описать формулой MX 2 E (осколочная структура). Для размещения всех пар необходимо 3 координационных места. Это осколок треугольной структуры. 1 место-для холостой пары, и 2 места для лигандов. Основа структуры - плоский треугольник. Холостая пара отталкивает связывающие пары. Геометрия молекулы угловая, но валентный угол меньше 120 0 из-за большего размера холостой пары (валентной пустышке нужно больше места в пространстве, и она расталкивает связывающие “трудовые” пары - смешно, но таков закон природы!). Таковы в газовой фазе молекулы SnCl 2 , PbCl 2 , GeCl 2 . Их структуры представляют из себя осколки “треугольника”. Её так и называют - осколочной.
4) В молекулах соединений элементов 5-й группы имеется несколько возможностей. У центрального атома 5 валентных электронов. Если он 5-валентный, то ещё 5 поступают от 5 лигандов. Получающиеся 5 пар занимают 5 координационных мест. Такую структуру можно описать формулой MX 5 (полная структура). Геометрия молекул этих соединений отвечает тригональной бипирамиде. Таковы PF 5 , AsCl 5 , SbBr 5 .
Здесь возникает качественное геометрическое различие лигандов. Два из них назовём аксиальными и три экваториальными. Соответствующие индексы введём для связывающих пар X a и X e , обслуживающих?-связи с лигандами (см. рис.в конце текста). Экваториальные положения предпочтительны для размещения и неподелённых пар и кратных связей, и более объёмных заместителей.
Если центральный атом- элемент 5-й группы лишь трёхвалентен, то от каждого лиганда в оболочку центра поступает 1 электрон, всего же оболочке центра приписывам 8 электронов - 4 пары. Три пары связывающие (X) и одна неподелённая E. Такую структуру можно описать формулой MX 3 E (осколочная структура). Все пары ориентированы к вершинам тетраэдра. Одно место занято парой-“пустышкой”, оттесняющей связи и искажающей “правильную” структуру. Лиганды размещены лишь в трёх положениях из пяти. Основа геометрии ядерного остова - тригональная пирамида, а с точки зрения теории ЛЭП она представляет собой осколочный тетраэдр. Таковы NH 3 , PCl 3 , PF 3 , AsCl 3 , SbBr 3 (а также-с центром из 6-й группы-изоэлектронный ион H 3 O +).
(Координационное место пустышки - понятием молекулярная структура игнорируется - как бы не в счёт, хотя именно она определяет структуру).
7) Молекулы соединений элементов 6-й группы. У центрального атома 6 валентных электронов. К шестивалентному центру поступают ещё 6 от 6 лигандов. Эти 6 пар требуют 6 координационных мест. Формула валентной оболочки центрального атома MX 6 (полная структура). Геометрия таких молекул октаэдрическая. Таковы SF 6 , SeCl 6 ... .
Если же центральный атом из 6-й группы лишь 4-х валентен, то формула оболочки центра MX 4 E (осколочная структура). Ей отвечает геометрия бисфеноида. Центру следует приписать 10 электронов - 5 пар, и основная структура для них - тригональная бипирамида с её 5-ю координационными местами. В 4-х координационных местах размещены лиганды, а их, как всегда, теснит пятая пара-“пустышка”. Она занимает более “комфортное” экваториальное место. На экваторе остается ещё два места, но валентный угол между ними меньше 120 0 , - их потеснит холостая пара. Два оставшихся атома занимают аксиальные положения, и поскольку они тоже оттеснены пустышкой от оси, то валентный угол между ними меньше 180 0 . Бисфеноид напоминает коромысло, поперёк которого повисли две руки. Согласно теории ЛЭП это осколок тригональной бипирамиды. Таковы структуры SF 4 , SeCl 4 , TeCl 4 , ...
9) Наконец, возможен и двухвалентный атом 6-й группы. Два лиганда добавят два электрона, и в поле центра окажется 8 электронов. Образуя 4 пары, они порождают 4 координационных места в вершинах тетраэдра. Формула оболочки центра MX 2 E 2 (осколочная структура). 2 пары занимают 2 вершины тетраэдра, и 2 лиганда располагаются в 2 оставшихся вершинах, а валентный угол вновь уменьшен по сравнению с тетраэдрическим. Он меньше 104 0 28". Эти структуры угловые. Таковы молекулы H 2 O, H 2 S, SCl 2 , SeCl 2 , TeCl 2 , ...
10) Структуры с 7-ю валентными парами у центра разнообразны. Варианты основной геометрии существенно меняются в зависимости от центрального атома или иона. Единого простого полиэдра, подходящего для построения полной структуры на основе центра из 7-й группы, уже нет. Единственный как бы простой случай полной структуры - у молекулы IF 7 имеет место структура пентагональной бипирамиды. А вот у XeF 6 также 7 пар в валентной оболочке центра, но уже иная структура - одношапочного октаэдра (см. рис.)
Наглядны и достаточно стандартны осколочные структуры. К ним и обратимся.
Если в поле элемента 7-й группы попадает 5 одновалентных лигандов, получаются 6 валентных пар. 1 из них холостая. Формула конфигурации центра MX 5 E. Основа геометрической структуры - осколок октаэдра. В его “ущербной“ аксиальной вершине 1 холостая пара, оттесняющая от идеальных положений прочие 5 связывающих пар. Получается структура квадратной пирамиды, или точнее “квадратного зонтика”, поскольку центральный атом лежит ниже плоскости четырёх лигандов.
Таковы ClFl 5 ; BrCl 5 ; BrF 5 ; ...
Если в поле элемента 7-й группы попадает 3 одновалентных лиганда, приходим к 5 валентным парам. Две из них холостые. Формула конфигурации центра MX 3 E 2 . Основа геометрической структуры - осколок тригональной бипирамиды (или двойной осколок бисфеноида). В его “ущербных” вершинах - экваториальные холостые пары, теснящие 3 связывающих. Две аксиальные пары отклонены от общей с центром оси в одну и ту же сторону. Получается структура буквы Т с валентными углами менее 90 0 . Таковы ClFl 3 ; BrCl 3 ; BrF 3 ...
11) Не являются исключением для теории ЛЭП соединения инертных газов. Есть смысл рассматривать осколочные структуры типа молекул XeF 2 , XeF 4 , ... их геометрия определяется теми же правилами.
В оболочку атома Xe в молекуле XeF 2 попадает 5 пар. Основа структуры - осколок тригональной бипирамиды. 3 неподелённые пары занимают экваториальные положения, располагаясь в трёх вершинах в плоскости равностороннего треугольника. Связывающие пары связей XeF менее объёмны, и занимают аксиальные положения на одной оси с центром. Ядерный остов линейный, но истинная основа геометрии это молекулы - тригональная бипирамида.
В оболочке атома Xe в молекуле XeF 4 содержится 6 пар. Основа структуры - октаэдр. 2 неподелённые пары располагаются на одной оси с центром. Менее объёмные связывающие пары связей XeF занимают 4 положения в общей плоскости с центром. Молекула квадратная, но её ЛЭП-основа - октаэдр.
В оболочке атома Xe в молекуле XeF 6 содержится 7 пар. Основа этой структуры в теории ЛЭП - так называемый одношапочный октаэдр. Это менее симметричная структура, но тем не менее, у неё сохраняется ось симметрии третьего порядка, проходящая через ось орбитали непо делённой пары, а также через центры двух плоскостей, в которых лежат треугольники, образованные двумя тройками атомов лигандов F" и F”.
12) Имеются соединения и с большим числом электронных пар...
Их примеры приведены в замечательной классической монографии Рональда Гиллеспи “Геометрия молекул”, а также в более новой монографии Р. Гиллеспи и И. Харгиттаи “Модель отталкивания электронных пар валентной оболочки и строение молекул”.
Резюме: Структуры, отвечающие определённому числу электронных пар, в валентной оболочке центрального атома могут быть полными и осколочными.
Геометрия полной структуры -правильный полиэдр. Во всех вершинах полиэдра у полной структуры находятся лиганды, их число равно формальной валености центрального атома, т.е. номеру группы центрального атома.
Геометрия осколочной структуры -осколок правильного полиэдра. В одной или нескольких вершинах теоретического полиэдра находятся неподелённые пары. Оставшиеся вершины заняты лигандами, их число меньше номера группы центрального атома. Валентные углы меньше, чем в правильном полиэдре. Осколочные структуры образуются при пониженной валентности центрального атома.
Следующие примеры приводятся для упражнений.
Соединения с кратными связями.
Аналогично рассматриваются и другие, в том числе некоторые когда-то казавшиеся невероятными структуры. В некоторых из них у лигандов кратные связи.
В качестве примеров можно рассмотреть молекулы
SF 3 N; SF 4 O; SO 2 ; IF 5 O; IO 3 - ; IF 2 O 2 - ; XeO 2 ; XeF 2 O 2 ;...
1) Молекула SF 3 N.
У центра 6 cсобственных валентных электронов, от лигандов ещё 3+3. Всего 6 пар. Тройная связь SN обслуживается 3-мя парами, которые занимают 1 координационное место. Остальные 3 пары связывающие и обслуживают 3 одинарные связи SF, занимающие 3 координационные места. Всего возникают 4 координационные места. Основа структуры - тетраэдр. Тройная связь занимает больший объём и, отталкивая, теснит связи SF, атомы F сближены, и валентные углы FSF меньше тетраэдрического значения 109 0 28". Валентный угол FSN, напротив, больше 109 0 28".
2) Молекула SF 4 O.
У центра 6 валентных электронов, от лигандов ещё 4+2. Всего 6 пар. Две из них принадлежат двойной связи, занимая одно общее координационное место в пространстве. Оставшиеся 4 пары связывающие и занимают 4 координационные места. Всего возникает 5 координационных мест. Основа структуры - тригональная бипирамида. Кратная связь =O имеет больший объём и находится на экваторе, отталкивая прочие связи. Все валентные углы FSF меньше идеальных. На экваторе - менее 120 0 , и аксиальные атомы отклонены от оси в направлении двух других экваториальных атомов, и валентный угол между ними менее 180 0
3) Молекула SO 2 .
У центра 6 валентных электронов, от лигандов ещё 2+2. Всего 5 пар. В 2-х координационных местах расположены 4 пары 2-х двойных связей. Одно координационное место занято холостой парой. Всего же возникает 3 координационных места. Геометрия молекулы угловая. Валеный угол OSO больше идеального значения 120 0 из-за взаимного отталкивания электронов двойных связей S=O.
4) Молекула IF 5 O.
У центра 7 валентных электронов, от лигандов ещё 5+2. Всего 7 пар, 1 связь двойная и 2 её пары занимают 1 координационное место. Отталкивая, она теснит остальные лиганды (связывающие пары), занимающие 5 координационных мест. Холостых пар 0. Основа структуры - немного деформированный октаэр, у которого 4 атома фтора сближены с одиночным, лежащим на общей оси с центром и атомом O. Все валентные углы FIF меньше 90 0 , а валентный угол FIO больше 90 0 .
5) Молекула IO 3 - .
У центра 7 валентных электронов, от лигандов ещё 2+2+2, и в состоянии аниона ещё один избыточный электрон. Всего 7 пар. На обслуживание 3-х двойных связей в трёх координационных местах выделено 6 пар. Одна пара остаётся холостой. В итоге для размещения 3-х двойных связей и 1 неподелённой пары используется 4 координационных места. Основа структуры - осколочный тетраэдр. Геометрия ядерного остова-тригональная пирамида. Кратные связи отталкивают друг от друга и неподелённую пару, и валентный угол OIO больше идеального тетраэдрического угла 109 0 28".
6) Молекула IF 2 O 2 - .
У центра 7 валентных электронов, от лигандов ещё 2+4 и плюс 1 избыточный электрон в состоянии аниона. Всего 7 пар. На обслуживание 2-х двойных связей на 2-х координационных местах поступают 4 пары, остаётся 1 неподелённая пара. В итоге для размещения 4-х лигандов и 1-й неподелённой пары необходимо 5 координационных мест. На экваторе располагаются 2 связи I=O и 1 неподелённая пара. Две связи I-F отклонены от оси F-I-F в направлении одиночной неподелённой пары, поскольку превалирует отталкивание от двух двойных связей I=O вследствие их большего объёма.
7) Молекула XeO 2 .
У центра 8 валентных электронов, от лигандов ещё 2+2. Всего 6 пар. На обслуживание 2-х двойных связей на 2-х координационных местах поступают 4 пары, остаются 2 неподелённые. В итоге для размещения лигандов и 1-й неподелённой пары необходимо 4 координационных места. Геометрия молекулы - осколочный тетраэдр с валентным углом O-Xe-O, увеличенным по сравнению с тетраэдрическим, поскольку объём кратных связей больше неподелённых пар.
8) Молекула XeF 2 O 2 .
У центра 8 валентных электронов, от лигандов ещё 2+4. Всего 7 пар. Для обслуживания занятых лигандами 4-х координационных мест, выделено 2+4=6 пар, остаётся 1 холостая пара. В итоге для размещения лигандов и 1-й неподелённой пары необходимо всего 5 координационных мест. Основа структуры - бисфеноид (осколок тригональной бипирамиды). На экваторе - атомы O и 1 холостая пара. Атомы F могут занимать лишь аксиальные положения, но при этом отклонены от оси связей F-Xe-F в направлении холостой пары, больше отталкиваясь от более объёмных связей Xe=O.
Так можно обсуждать структуру многих молекул, и молекулярных ионов. У молекулярных ионов следует дополнительно добавить электроны (у анионов) или вычесть (у катионов) электронов, формируя необходимую “стереохимическую электронную ЛЭП-конфигурацию” центрального атома. (Осторожно! Термин нестандартный)
Резюме: Изложенным правилам и приёмам можно придать простую
математическую форму.
Пусть в молекуле центральный атом M, является атомов sp-элемента и содержит всего G электронов на АО валентного уровня, и лиганды (L";L”;L"”) содержащиеся в количествах (l";l”;l"”), образуют связи разной кратности, например (1,2,3). Формулу молекулы запишем в виде M(L") l "(L”) l” (L"”) l " ” .
Число B всех связывающих пар X центра с лигандами равно полному числу образуемых лигандами (и центром) связей: B =(1l"+2l”+3l"”).
Число всех электронов, приписываемых к валентной оболочке центрального атома, равно сумме всех G электронов валентного уровня центра с числом B. Половина суммы и есть искомое число всех пар: A=(G+B)/2=(G+1l"+2l”+3l"”)/2.
Число неподелённых пар E центра M, которые, как и лиганды, также занимают координационные места у центра, равно разности:
AB=(G+1l"+2l”+3l"”)/2(1l"+2l”+3l"”)=(G1l"2l”3l"”)/2.
Число k образуемых в поле центра координационных мест равно числу k вершин полиэдра - трафарета структуры молекулы. Оно складывается из числа лигандов и числа неподелённых пар, т.е.
k =l"+l”+l"”+AB.
Так получаем структуру вида MX n E m в виде MX l " +l”+l " ” E A-B .
Искажение валентных углов вызывают:
в первую очередь кратные связи,
во вторую очередь неподелённые пары,
затем связывающие пары в порядке убывания их объёма (увеличения электроотрицательности).
объёмные заместители сложные искажают структуру подобно неподелённым парам.
Гибридизация АО центрального атома.
В теории ЛЭП все электроны валентной оболочки приписывают к центральному атому. Отсюда иногда легко определить число и природу атомных орбиталей, которые у центра выделены для их размещения.
В валентном состоянии центрального атома эти АО гибридизованы - смешаны с единичными коэффициентами.
Иногда возможно определить тип гибридизации и порождаемую им ориентацию?-связей молекулы.
Структуры теории ЛЭП и гибридизация АО центрального атома.
Рассматривая валентные конфигурации центрального атома, следует все приписанные к нему электроны валентной оболочки разместить на АО его валентного и близлежащих вакантных подуровней. Получаем:
MX 2 в пределах двух АО (s+p). Гибрид sp образует 2 равноценные?-АО,
ориентированные в противоположные стороны вдоль общей оси.
Получается ЛИНИЯ.
MX 3 и MX 2 E в пределах трёх АО (s+2p). Гибрид sp 2 , образует 3 равноценные?-АО, ориентированные к вершинам равностороннего треугольника.
Получается ТРЕУГОЛЬНИК.
MX 4 ; MX 3 E; MX 2 E 2 для этого необходимы уже четыре АО (s+3p). Гибрид sp 3 ,
образует 4 равноценные?-АО. Получается ТЕТРАЭДР.
MX 5 ; MX 4 E; MX 3 E 2 ; MX 2 E 3 для этого необходимы уже пять АО (s+3p+d). Одна
из пяти АО - это d-АО ближайшего выше лежащего уровня. Гибрид dsp 3 ,
образует два типа?-АО, и потому три лиганда экваториальные и два -
аксиальные. Получается ТРИГОНАЛЬНАЯ БИПИРАМИДА.
MX 6 ; MX 5 E; MX 4 E 2 в пределах пяти АО (s+3p+2d). Две АО из шести это две d-
АО близлежащего выше лежащего уровня. Гибрид d 2 sp 3 , образует шесть
равноценных?-АО. Получается ОКТАЭДР.
ВНИМАНИЕ! Связь теории ЛЭП с теорией гибридизации и теорией направленных валентностей очень важна, и из теории ЛЭП иногда её можно установить. Создаётся впечатление логически завершённого вывода типа гибрида центрального атома, но это не всегда достижимо! Всё же теория ЛЭП построена для соединений непереходных элементов. И уже на гибриде типа dsp 2 она «спотыкается» - не предвидится в ней этот естественный для комплексов вариант... Не стоит переоценивать ни один из подходов. В современной квантовой химии не существует всеобъемлющих качественных концепций.
Основные структуры молекул непереходных элементов,
предсказываемые теорией ЛЭП
Представления о направленности связи и теория гибридизации электронных орбиталей позволяют объяснить геометрическую форму молекул веществ с ковалентными связями, но не предсказать ее. Теоретический расчет геометрической конфигурации частицы квантово-механическими методами представляет собой очень сложную и не всегда имеющую однозначное решение задачу. Однако существует довольно простой прием, позволяющий с достаточно высокой надежностью качественно оценить геометрию молекул. Этот прием был разработан Р. Гиллеспи и получил название теории отталкивания электронных пар валентной оболочки, так как связывает форму частицы с силами отталкивания, действующими между электронными парами, сформированными при образовании соответствующей молекулы. Чтобы определить геометрическую форму молекулы по методу Гиллеспи, необходимо знать электронные конфигурации атомов, порядок соединения этих атомов в молекуле, число s- и p-связей в образовавшейся частице. Теория Гиллеспи особо результативна для молекул, образованных s- и р-элементами.
Теория отталкивания электронных пар валентной оболочки может быть сведена к следующим основным положениям:
1. На геометрическую форму молекулы основное влияние оказывает число электронных пар валентной оболочки (ЭПВО), к которым относятся электронные пары, образующие s-связи и остающиеся неподеленными. Электронные пары, образующие p-связи, не влияют на геометрию молекул.
2. Электронные пары валентной оболочки ориентируются так, чтобы отталкивание между ними было минимально. Число электронных пар валентной оболочки определяет тип гибридизации центрального атома.
3. Форма молекулы определяется соотношением числа связывающих и неподеленных ЭПВО. Если центральный атом, для которого устанавливается тип гибридизации, не имеет неподеленных пар, форма молекулы определяется типом гибридизации этого атома.
4. Неподеленные электронные пары, сосредоточенные возле одного атома, занимают больший объем околоядерного пространства, чем связывающие электронные пары, распределенные между двумя атомами. В результате наибольшее отталкивание реализуется между двумя неподеленными парами, наименьшее - между двумя связывающими парами. Следствием неэквивалентности неподеленных и связывающих электронных пар является искажение валентных углов.
Чтобы определить число ЭПВО необходимо сложить число валентных электронов данного атома с числом электронов, предоставленных присоединенными атомами, а затем из полученной суммы вычесть число электронов, образующих p-связи, и разделить полученный результат на два. Так, например, в случае молекулы СО 2 , имеющей две s- и две p-связи, каждый атом кислорода предоставляет по два электрона на образование связей с атомом углерода, а атом углерода предоставляет по два электрона на образование связей с каждым атомом кислорода. Соответственно число ЭПВО для атома углерода равно 2.
а для атома кислорода – 3.
![]()
Число связывающих ЭПВО (n C) равно числу s-связей, образуемых центральным атомом (n s); разность
n Н = N ЭПВО - n s равна числу неподеленных ЭПВО.
Пусть валентная оболочка атома в молекуле включает две электронные пары. Два одноименных точечных заряда, оказавшись на поверхности сферы, расположатся на концах диметра большого круга; соответственно две ЭПВО должны занять орбитали, обеспечивающие валентный угол 180°. Отсюда можно заключить, что в случае двух ЭПВО атом подвергается sp-гибридизации (например, атом углерода в молекуле СО 2).
С помощью несложных расчетов можно показать, что максимальному удалению и минимальному отталкиванию трех ЭПВО будет отвечать ориентация орбиталей от центра к вершинам равностороннего треугольника, лежащего в плоскости большого круга, т.е. sp 2 -гибридизация. Четырем ЭПВО соответствует тетраэдрическая конфигурация (sp 3 -гибридизация). В случае пяти ЭПВО наиболее выгодным является распределение электронных пар по орбиталям, направленным к вершинам тригональной бипирамиды (sp 3 d-гибридизация). Шести ЭПВО соответствует октаэдрическая конфигурация, обеспечиваемая sp 3 d 2 -гибридизацией. Если на валентной оболочке находится более шести электронных пар, вопрос о конфигурации не может быть решен однозначно. Так семи ЭПВО с равной вероятностью могут отвечать три формы координационного многогранника: пентагональная бипирамида, октаэдр с дополнительной вершиной над одной из граней и тригональная призма с дополнительной вершиной над боковой гранью.
При наличии неподеленных пар, занимающих гибридные орбитали, форма координационного многогранника изменяется в зависимости от числа неподеленных пар. Идеальные геометрические формы, отвечающие различным значениям числа ЭПВО и неподеленных электронных пар (n H), приведены в табл. 16. В таблицу включены также примеры молекул той или иной формы; в скобках указан атом, для которого определяется тип гибридизации.
Таблица 16
Типы молекул, отвечающие различным числам связывающих и неподеленных
электронных пар
| Число ЭПВО | Тип гибри-дизации | Число неподеленных пар | |||
| sp | линейная BeF 2 (Be) | линейная AlF (Al) | |||
| sp 2 | треугольник BF 3 (B) | угловая SnCl 2 (Sn) | линейная NH (N) | ||
| sp 3 | тетраэдр CF 4 (C) | тригональная пирамида NH 3 (N) | угловая Н 2 О (О) | линейная IF (I) | |
| sp 3 d | тригональная бипирамида PF 5 (P) | бисфеноид SF 4 (S) | T-форма IF 3 (I) | Линейная XeF 2 (Xe) | |
| sp 3 d 2 | октаэдр SF 6 (S) | тетрагона-льная пирамида BrI 5 (Br) | квадрат XeF 4 (Xe) | Т-форма - (Xe) |
Как следует из табл. 16, в случае двух ЭПВО возможно образование только линейных молекул. Для трех ЭПВО молекулы могут быть треугольными (n H = 0), угловыми (n H = 1) и линейными (n H =2). Наличие в валентной оболочке четырех электронных пар допускает образование тетраэдрических (n H = O), тригонально-пирамидальных (n H = 1), угловых (n H = 2) и линейных (n H = 3) молекул.
Если число ЭПВО равно пяти и все пары являются связывающими, молекула имеет форму тригональной бипирамиды. При наличии неподеленных ЭПВО для определения геометрии молекулы необходимо знать, какие орбитали, аксиальные или экваториальные, занимают неподеленные электронные пары. Расчет показывает, что более выгодным является экваториальное положение; действительно, занимающие экваториальное положение неподеленные пары имеют только двух ближайших соседей под углом 90 °, тогда как при аксиальном положении таких соседей было бы три, что привело бы к более сильному отталкиванию. В результате молекула с одной неподеленной парой имеет форму бисфеноида (искаженный тетраэдр), с двумя - Т-форму, а трем неподеленным парам соответствуют линейные молекулы.
В случае шести ЭПВО неподеленные пары, стремясь к максимальному взаимному удалению, занимают в октаэдре транс-положения друг относительно друга. В силу этого для шести ЭПВО реализуются следующие формы молекул: октаэдр (n H = 0), тетрагональная пирамида (n H = 1), квадрат (n H = 2), Т-форма (n H = 3). Четырем и пяти неподеленным парам должны отвечать линейные молекулы, однако обнаружить подобные соединения не удалось.
Приведенные в табл. 16 геометрические формы молекул являются идеальными; в реальных же молекулах возможны определенные искажения их геометрии. Рассмотрим причины, обуславливающие эти искажения.
1. Наличие в молекуле неподеленных электронных пар . В соответствии с третьим положением теории Гиллеспи наличие неподеленных пар приводит к сжатию валентных углов в молекулах. Так, например, в идеальном случае валентные углы молекулы SF 4 (N ЭПВО = 5, n H = 1) равнялись бы 180 °(ÐF акс SF акс), 120 °(ÐF экв SF экв) и 90 ° (ÐF акс SF экв); в действительности соответствующие углы равны 173,1 °, 101,5 ° и 87,8°. Искажение валентных углов тем сильнее, чем ниже в соответствующей подгруппе находится данный элемент.
2. Наличие в молекуле двойных и тройных связей . Двойные и тройные связи короче одинарных и занимают больший объем у центрального атома, что приводит к сжатию валентных углов между парами, образующими одинарную связь. Так для молекулы COCl 2 , в которой атом кислорода образует с углеродом двойную связь, а атомы хлора - одинарные, числа ЭПВО и неподеленных пар составляют
![]()
n н = 3 - 3 = 0
Поэтому молекула COCl 2 должна иметь форму равностороннего треугольника с валентными углами, равными 120°. В действительности же эта молекула имеет форму равнобедренного треугольника (d C=O = 117 пм, d C-Cl = 175 пм, Ð ClCO = 124 °, Ð С lCCl = 111 °).
3. Неравноценность присоединенных атомов . Если присоединенные атомы имеют различные радиусы, то и длины связей, и валентные углы в образовавшейся молекуле не будут одинаковы. Так, для молекулы CCl 4 и CHCl 3 число ЭПВО и неподеленных пар одинаково (N ЭПВО = 4, n Н = 0). Однако молекула тетрахлорида углерода имеет форму правильного тетраэдра (dC-Cl = 176 пм, ÐClCCl = 109,5 °), а молекула хлороформа является искаженным тетраэдром (d C-Cl =176 пм, d C-H = 110 пм, ÐClCCl = 111,3 °, ÐHCCl = 107,5°).
Рассмотрим несколько примеров определения формы молекул по методу Гиллеспи.
Если в молекуле отсутствуют цепочки, содержащие более трех атомов, то для определения ее геометрии достаточно установить тип гибридизации и число неподеленных ЭПВО центрального атома, выбрать по табл. 16 идеальный тип молекулы и внести коррективы, связанные с ожидаемым искажением формы молекулы. Пусть, например, необходимо определить форму молекулы оксофторида ксенона XeO 2 F 2 , в которой центральным является атом ксенона, образующий четыре s- и две p-связи. Числа ЭПВО и неподеленных пар для этой молекулы составляют 5 и 1 соответственно.
; n н = 5 - 4 = 1
В соответствии с табл. 16 орбитали ксенона подвергаются sp 3 d-гибридизации, а образующаяся молекула имеет форму бисфеноида, в котором атомы кислорода образуют связи за счет экваториальных орбиталей, обеспечивающих этим атомам максимальное удаление от орбитали, занятой неподеленной парой, а атомы фтора, имеющие по три неподеленные пары, находятся в транс-положении. Можно ожидать, что длина двойных связей Xe=O будет меньше длины одинарных связей Xe-F, а углы OXeO и FXeF в связи с наличием неподеленной пары на экваториальной орбитали будут меньше 120 ° и 180 ° соответственно. Эти предположения хорошо согласуются с результатами экспериментального определения формы рассматриваемой частицы (рис. 21,а): молекула XeO 2 F 2 действительно имеет форму слегка искаженного бисфеноида (d Xe=O = 171 пм, d Xe-F = 190 пм, ÐOXeO = 105,7 °, ÐFXeF = 174,7°).
При определении геометрии сложных молекул, содержащих цепочки из четырех и более атомов, рационально разбить молекулу на фрагменты и определить геометрию каждого из них отдельно. Например, при определении формы газообразного метабората натрия Na-O-B=O следует порознь определить форму фрагментов O=B-O и B-O-Na. Для атома бора в O=B-O
N н = 2 - 2 = 0
т.е. этот фрагмент имеет линейную форму. Для атома кислорода в B-O-Na
![]() n н = 4 - 2 = 2
n н = 4 - 2 = 2
Этот фрагмент, таким образом, имеет угловую форму, а валентный угол близок к 109,5 °. Как следует из рис. 21,б, молекула NaBO 2 действительно представляет собой сочетание линейного и углового фрагментов с валентными углами 180 ° и 109 °.

Рис. 21. Геометрия молекул XeOF 2 (а), NaBO 2 (б) и SO 2 (в)
Если частица является ионом, то при расчете числа ЭПВО следует вычесть заряд иона из числа валентных электронов. Определим геометрию иона IO 2 F 2 - . Для атома иода, являющегося центральным и образующего четыре s- и две p-связи
N н = 5 - 4 = 1
Рассматриваемый ион должен иметь форму бисфеноида, что подтверждено экспериментально.
Число ЭПВО можно рассчитать также, исходя из электронных конфигураций ионов, образующих данную частицу. Например, ион 3 - образован ионом Al 3+ и шестью ионами F - ; связи в этой частице образованы по донорно-акцепторному механизму, причем ион F - предоставляет для образования связи электронную пару. Отсюда для атома алюминия
![]() n н = 6 - 6 = 0
n н = 6 - 6 = 0
Алюминий, таким образом, подвергается sp 3 d 2 -гибридизации, а ион 3- имеет форму октаэдра.
Если в частице имеются нелокализованные связи, следует определить геометрию всех канонических форм, а затем усреднить полученные структуры. Например, для молекулы диоксида серы возможны две канонические формы, отличающиеся тем, с каким атомом кислорода атом серы образует двойную связь:
![]()
Для атома серы
(являющийся акцептором атом кислорода электронов на образование связи не предоставляет); отвечающая этой канонической форме частица должна иметь угловое строение и разные длины связей S=O и S®O. Усреднение структур канонических форм приводит к симметричной угловой молекуле, в которой длины связей сера-кислород одинаковы (рис. 21,в).
Надежность метода Гиллеспи применительно к соединениям s- и p-элементов весьма высока: вероятность правильного предсказания геометрии молекул составляет 90-95%. Применение теории отталкивания ЭПВО к соединениям d-элементов встречает определенные затруднения, однако в ряде случаев дает вполне удовлетворительные результаты, особенно для элементов, содержащих на валентном уровне от одного до семи, а также десять электронов. При этом для d-элементов, имеющих вакантные d-орбитали, становятся возможными некоторые типы гибридизации, не реализующиеся в случае s- и p-элементов. Так, для шести, пяти и четырех ЭПВО, наряду с гибридизацией типа sp 3 d 2 , sp 3 d, sp 3 становятся возможными и энергетически более предпочтительными d 2 sp 3 -, dsp 3 и d 3 s-гибридизация. При расчете числа ЭПВО для атомов d-элементов следует брать от центрального атома не все валентные электроны, а лишь то число их, которое обеспечивает проявляемую атомом степень окисления. Так, например, при определении геометрической формы пентахлорида вольфрама WCl 5 от атома вольфрама следует брать не шесть, а пять электронов, так как в рассматриваемом соединении вольфрам имеет степень окисления +5. Тогда
ГИЛЛЕСПИ ТЕОРИЯ
система постулатов и правил для объяснения и предсказания геом. конфигурации молекул на основе принципа Паули и модели отталкивания электронных пар валентных орбиталей. Согласно Г. т., пространственная направленность хим. связей поливалентного атома в молекуле зависит прежде всего от общего числа электронов в его валентной оболочке. Электронные облака связывающих атомы электронных пар и электронов на несвязывающих орбиталях (т. е. неподеленных пар валентной оболочки атомов) грубо представляются в виде жестких сфер соотв. меньшего и большего диаметров. Атомный остов, включающий ядро и внутр. электронные оболочки, также считается сферическим (с нек-рыми исключениями). Сферич. облака электронных пар окружают остов так, что их взаимное отталкивание минимально, т. е. они максимально удалены друг от друга. Такая модель позволяет оценивать в молекулах. Идеальные конфигурации и значения валентных углов для молекул с числом псфер одинакового диаметра приведены в таблице.
ТИПЫ КОНФИГУРАЦИЙ МОЛЕКУЛ

При разл. диаметрах сфер (связывающих и неподеленных пар электронов) образуются искаженные конфигурации с валентными углами, отличающимися от их идеальных значений. Напр., в молекулах СН 4 , NH 3 и Н 2 О в валентных оболочках атомов С, N и О находятся четыре электронные пары, но для СН 4 они все связывающие, а у атомов азота и кислорода имеются соотв. одна и две неподеленные электронные пары. Поэтому идеальную тетраэдрич. конфигурацию имеет лишь СН 4 ; в молекулах NH 3 и Н 2 О валентные углы меньше тетраэдрического. Оценка радиусов электронных сфер и атомных остовов с использованием значений ковалентных и ионных радиусов атомов, а также постулатов Г. т., касающихся кратных, полярных связей и др., позволяет судить и о длинах связей в молекулах. Г. т. дает результаты качеств. или полуколичеств. характера и применяется гл. обр. в химии неорг. и координац. соединений. Теория полезна также при рассмотрении фрагментов цепных, слоистых и объемных кристаллич. структур.
Осн. положения теории сформулировали Р. Найхолм и Р. Гиллеспи в 1957.
Лит.: Гиллеспи Р., Геометрия молекул, пер. с англ., М., 1975; Минкин В. И., Симкин Б. Я., Миняев Р. М., Теория строения молекул, М., 1979. Ю. А. Пентин.
Химическая энциклопедия. - М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Смотреть что такое "ГИЛЛЕСПИ ТЕОРИЯ" в других словарях:
Валентных орбиталей (ОЭПВО) один из подходов в химии, необходимый для объяснения и предсказания геометрии молекул. Согласно этой теории молекула всегда будет принимать форму, при которой отталкивание внешних электронных пар минимально… … Википедия
В Википедии есть статьи о других людях с такой фамилией, см. Гиллеспи. Гиллеспи, Роналд Джеймс англ. Ronald James Gillespie Дата рождения: 21 августа 1924(1924 08 21) (88 лет) … Википедия
Рис.1. Электронная теория химической связи была предложена и развита американским физикохимиком Льюисом Г.Н в 1912 1916 гг … Википедия
- (комплексные соед.), содержат катионный, анионный или нейтральный комплекс, состоящий из центр. атома (или иона) и связанных с ним молекул или ионов лигандов. Центр. атом (комплексообразователь) обычно акцептор, а лиганды доноры электронов, и при … Химическая энциклопедия
У этого термина существуют и другие значения, см. Гибридизация. Модель молекулы метана, образованной sp3 гибридными орбиталями … Википедия